Grupos del Instituto de Neurociencias (CSIC-UMH) trabajan en paliar esta ‘pandemia invisible’
Redacción
Varios equipos del Instituto de Neurociencias (IN-CSIC-UMH), en Alicante, trabajan en distintas líneas de investigación para lograr un futuro sin alzhéimer, una enfermedad que afectará a más de 82 millones de personas en 2030 en todo el mundo y que casi se duplicará en 2050, con 152 millones de casos. En línea con el lema de la Confederación Española de Alzheimer (CEAFA), InvestigaAcción, los científicos buscan soluciones para paliar lo que califican como “una pandemia invisible”, ya que es una de las principales causas de discapacidad y dependencia entre las personas mayores a nivel mundial. En España la padecen más de 1,2 millones de personas.
Cada 21 de septiembre se celebra, desde 1994, el Día Mundial del Alzheimer, instituido por la Organización Mundial de la Salud (OMS) y auspiciado por Alzheimer’s Disease Internacional (ADI). La amenaza más importante para una buena calidad de vida a partir de los 60 años es el deterioro cognitivo, y, en concreto, la demencia asociada a la Enfermedad de Alzheimer, que afectará a más de 82 millones de personas en 2030 en todo el mundo y que casi se duplicará en 2050, con 152 millones de casos
El envejecimiento es el principal factor de riesgo para desarrollar alzhéimer. Una de cada 10 personas de más de 65 años padece esta enfermedad en España, y, a los 85 años, afecta ya a 3 de cada 10 personas. El coste anual de esta pandemia de alzhéimer se estima, según la OMS, en alrededor del 1% del PIB de los países. En España, según cifras de la Sociedad Española de Neurología, sus costes alcanzan los 60 millones de euros diarios, asumidos en un 87% por las familias afectadas.
En 2030, una de cada cinco personas residentes en Europa y Estados Unidos habrá alcanzado los 65 años. Y en 2035 las personas de más de 65 años superarán por primera vez en número a los menores de 18. Como consecuencia, la prevención de las enfermedades relacionadas con la edad adquiere una importancia creciente para la salud pública.
Mecanismos moleculares alterados
Los beneficios traslacionales del grupo de investigación liderado por Mª Salud García Ayllón y Javier Sáez Valero radican en que analizan la alteración de mecanismos moleculares en el alzhéimer, definiendo un potencial uso diagnóstico e implicación en terapia.
Este grupo forma parte de CIBERNED (Centro de Investigación Biomédica en Red en Enfermedades Neurodegenerativas, ISCIII) y cuenta con miembros de FISABIO (Fundación para Fomento de Investigación Sanitaria y Biomédica de la Comunidad Valenciana) e ISABIAL (Instituto de Investigación Sanitaria y Biomédica de Alicante). Tienen colaboraciones internacionales en el proyecto BiomarkADPD (una iniciativa dentro del programa JPND de la UE) y la Society for CSF analysis and clinical biochemistry, para la validación y estandarización de protocolos de determinación de biomarcadores en líquido cefalorraquídeo (LCR).
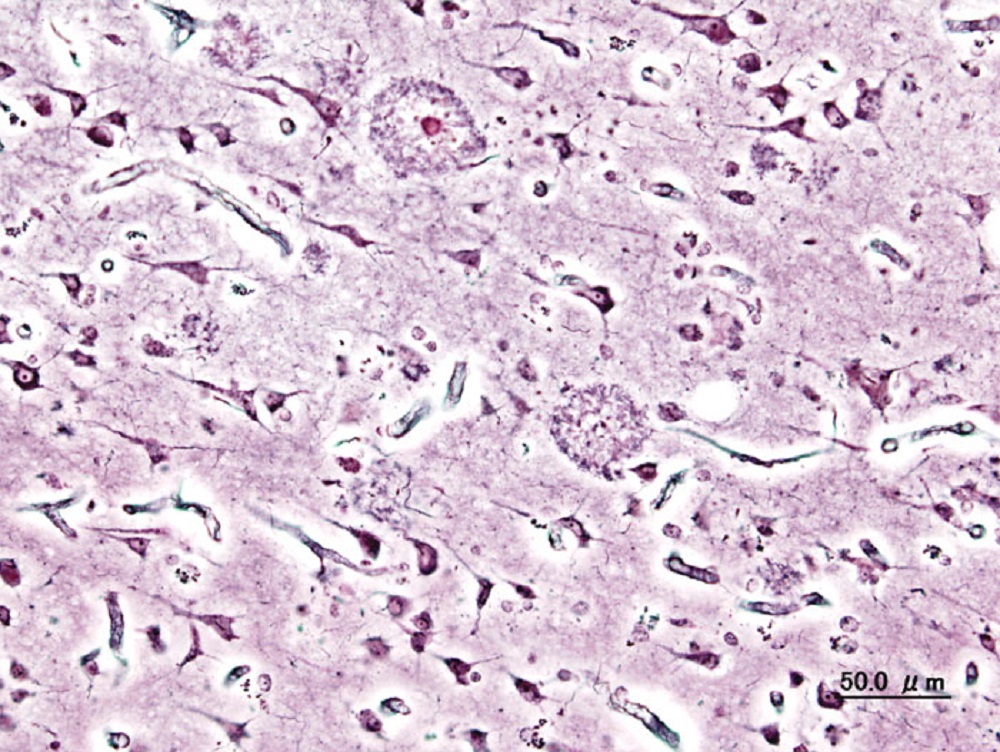
Los investigadores estudian parte de los principales mecanismos alterados en la Enfermedad de Alzheimer y la interrelación entre ellos, trabajos que han derivado en hallazgos relevantes, como la demostración de un mecanismo novedoso por el cual el β-amiloide regula la expresión y la glicosilación de la reelina, lo que influye en su cascada de señalización. La reelina es una proteína de señalización que modula la función sináptica y la plasticidad en el cerebro a través de la interacción con los receptores de la apolipoproteína E, que es el principal factor de riesgo genético para la EA esporádica, asociada a la edad.
También han descrito un nuevo receptor de apolipoproteína E que influye en el procesamiento amiloide. Han desarrollado nuevos biomarcadores del líquido cefalorraquídeo, evaluando el potencial diagnóstico de determinadas formas glicosiladas de proteínas (incluida APP), que mejoran la sensibilidad y la especificidad de los biomarcadores.
El cerebro en el envejecimiento y el alzhéimer
Liderado por José Vicente Sánchez Mut, este equipo investiga los fundamentos moleculares del declive cognitivo relacionado con la edad y la neurodegeneración, con un interés particular en la Enfermedad de Alzheimer. Su hipótesis es que la interacción entre la genética y la epigenética modula el riesgo de sufrir la enfermedad. Para abordar esta hipótesis, utilizan modelos de ratones y muestras humanas, y combinan la neurociencia molecular y del comportamiento con las más avanzadas tecnologías de célula única, secuenciación de última generación, herramientas bioinformáticas y edición epigenética.

Su objetivo final es entender mejor el mal funcionamiento del cerebro relacionado con la edad para identificar nuevos biomarcadores y objetivos farmacológicos, así como seguir mejorando las actuales terapias relacionadas con la enfermedad.
Frenar la progresión de la enfermedad
La búsqueda de intervenciones preventivas y terapias que logren, al menos, frenar el avance de la enfermedad, es el objetivo del equipo liderado por Jose P. López-Atalaya, un grupo de reciente creación en el IN-CSIC-UMH.

Las causas principales que inician el deterioro cognitivo y de la memoria en la Enfermedad de Alzheimer son desconocidas. Sin embargo, el riesgo de padecer la enfermedad de inicio tardío, la forma más común, está altamente influenciada por la genética (la proporción atribuible a factores genéticos es del 60% al 80%) y, en ella, la respuesta inflamatoria tiene un papel clave. Las investigaciones del equipo de López-Atalaya están centradas en evaluar esta hipótesis y en la búsqueda de nuevos medios para modificar la progresión de la enfermedad a través de la modulación de la respuesta inmunitaria.

