Ahora decide autorizarlo para un perfil concreto de paciente y siempre que se adopten “medidas de minimización del riesgo”
Redacción
El comité de expertos de la Agencia Europea del Medicamento (EMA, por sus siglas en inglés) ha recomendado el pasado jueves la aprobación del lecanemab, el primer fármaco que ha demostrado tener algún efecto contra el alzhéimer en décadas, pero que es controvertido por sus efectos secundarios y su alto precio.
La agencia había vuelto a reunir a sus expertos después de que los fabricantes del fármaco recurriesen su decisión inicial de rechazarlo, publicada en verano.
En su nueva resolución, el Comité de Expertos en Medicamentos de Uso Humano ha recomendado el uso de este fármaco, pero limitado a los pacientes que no tengan ninguna copia del gen APOE4 o solo una. De esta forma quedan excluidos los pacientes con dos copias de este gen (en torno a un 15% del total), pues este perfil genético está muy relacionado con la inflamación y las hemorragias que puede producir el fármaco.
Un paciente se prepara para un escáner cerebral 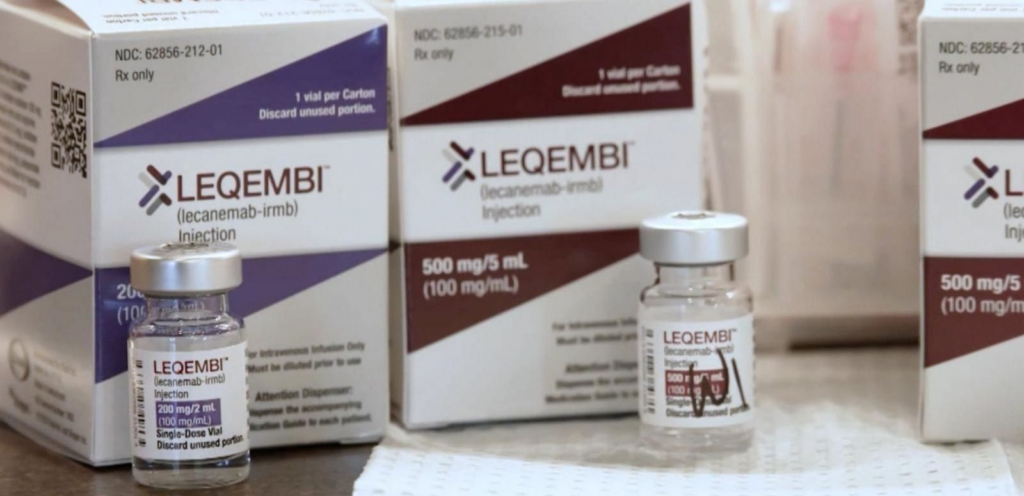
La EMA suele seguir las recomendaciones de su comité, por lo que probablemente se apruebe su uso en toda la Unión Europea. Después de ese trámite, cada país de la unión deberá negociar un precio con la farmacéutica y decidirán si lo cubre la sanidad pública. En Estados Unidos, donde el fármaco ya está aprobado, el precio por paciente al año es de 26.500 dólares al año, unos 24.000 euros.
El lecanemab, con nombre comercial Leqembi, ha demostrado retrasar el avance de la enfermedad un 27%, según los resultados de un ensayo clínico con 1.700 pacientes en varios países —incluida España— durante año y medio. La gran pregunta es si ese modesto efectos se traduce en mejoras reales para los pacientes y sus cuidadores. Durante el ensayo, el fármaco causó inflamación cerebral en el 12% de los pacientes que lo tomaron, y dos de ellos murieron por hemorragias cerebrales relacionadas con el medicamento.
SEGUIMIENTO DE PACIENTES
Las dos compañías que han desarrollado Leqembi, la japonesa Eisai y la estadounidense Biogen, han presentado datos adicionales de seguimiento de pacientes durante tres años que muestran que la mejora cognitiva se mantiene si se continúa el tratamiento, y que estaría justo en el umbral de la relevancia clínica. Además, dicen, no ha habido ninguna otra muerte. Pero estos datos aún no han sido revisados por expertos independientes ni publicado en una revista científica.
Estoy satisfecho de que la razón haya vuelto a su cauce
BART DE STROOPER
Con esta decisión, Europa se suma al resto de países que han decidido aprobar el fármaco, entre ellos Estados Unidos, China, Japón, Israel, Corea del Sur o Emiratos Árabes. Reino Unido también ha aprobado su uso, pero su sistema de salud público no lo financiará, pues considera que sus efectos son demasiado modestos para su coste, de unos 24.000 euros al año por paciente.
El alzhéimer es la principal causa de demencia, y afecta a unos 50 millones de personas en el mundo. El envejecimiento de la población amenaza con que estas cifras se multipliquen antes de mediados de siglo.
Fuente: Rtve.es – elpais.es y sciencemediacentre

